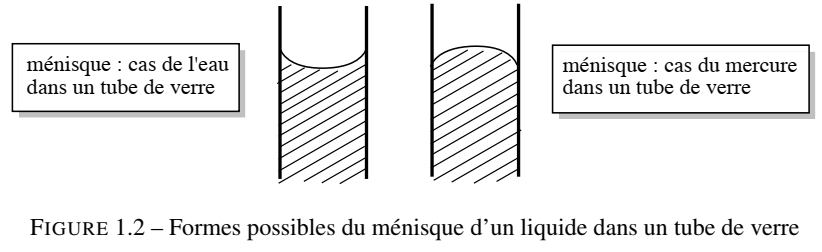
On appelle capillarité d’un liquide l’ascension spontanée du liquide dans un tube capillaire dans le champ de pesanteur.
Le phénomène de capillarité est imputable à l’existence de forces de cohésion dans le liquide et à l’existence de forces d’adhésion (interaction attractive entre les molécules du liquide et celles de la paroi du récipient contenant le liquide). Si le diamètre du tube contenant le liquide est faible, alors les forces d’adhésion dominent et peuvent permettre une ascension du liquide à une hauteur détectable. Une indication des forces relatives d’adhésion et de cohésion du liquide est la formation d’un ménisque : c'-à-d la surface courbe d’un liquide dans un tube étroit. Ainsi, les bords du ménisque de l’eau dans un capillaire de verre sont courbés vers le haut (ils forment une surface concave) parce que les forces d’adhésion entre les molécules d’eau et les atomes d’oxygène ou les groupements -OH présents à la surface du verre ordinaire ont une intensité comparable (voire supérieure) aux forces de cohésion entre molécules d’eau. Mais dans un liquide comme le mercure, le ménisque est convexe, car les forces de cohésion sont supérieures aux forces d’adhésion au verre.
Summary
| status | not read | reprioritisations | ||
|---|---|---|---|---|
| last reprioritisation on | suggested re-reading day | |||
| started reading on | finished reading on |