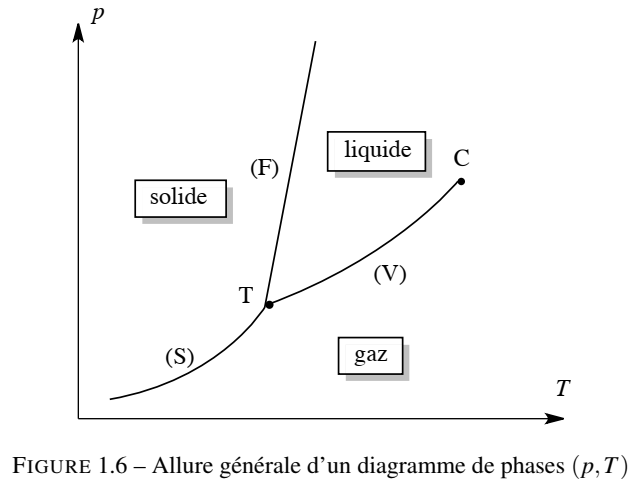
Le diagramme de phases ( ou diagramme d'état ) ( p,T) d’un corps pur est la représentation graphique des conditions de température T et de pression p auxquelles les différentes phases sont thermodynamiquement stables. Le plan est divisé en régions correspondant aux domaines d’existence de chaque état. Un diagramme de phase laisse apparaître des frontières entre ces régions. Ces frontières indiquent les conditions de pression et de température pour lesquelles deux phases coexistent (on dit que les deux phases sont en équilibre). Il s’agit alors d’une situation d’équilibre appelé équilibre dynamique : en permanence des molécules du corps pur quittent et gagnent chacune des phases coexistantes, sans pour autant modifier la composition globale du système diphasé.
Nous présentons sur la figure 1.6 la forme du diagramme de phases (p, T) pour la plupart des corps purs, à l’exception notable de l’eau ( pure ). La frontière notée (V) est appelée courbe de vaporisation, la frontière notée (S) est appelée courbe de sublimation, et la courbe notée (F) est appelée courbe de fusion du corps pur. La courbe de vaporisation entre les domaines d’existence du liquide et du gaz représente une fonction du type p(T) pour laquelle on observe la coexistence entre les phases liquide et gaz.
Nous repérons deux points particuliers sur la diagramme de phases (p ; T) :
- Le point T : le point T de coordonnées (pT ;TT) est appelé point triple du corps pur. Il correspond à la situation de pression et de température pour laquelle les trois phases (solide, liquide, gaz) coexistent.
- et le point C : le point C de coordonnées (pC ; TC) est appelé point critique du corps pur. Il s’agit de l’extrémité " supérieure " de la courbe de vaporisation qui s’arrête brusquement. Un fluide très proche de son point critique change de façon continue de l’état liquide à l’état gazeux, causant des fluctuations de densité d’une région à l’autre. Ces fluctuations diffusent fortement la lumière (comme un brouillard) et le système paraît laiteux. Cet effet est appelé opalescence critique. Pour des températures supérieures à TC ou des pressions supérieures à pC, la phase gazeuse se confond avec la phase liquide sous la forme d’une phase uniforme appelée fluide supercritique. Ce fluide supercritique remplit le récipient qui le contient et il n’y a plus d’interface liquide/gaz.
La figure 1.6 présente une version simplifiée des diagrammes de phases des corps purs. Il faut savoir que la réalité des diagrammes de phases des corps purs est bien plus complexe, notamment à cause de l’existence de variétés allotropiques à l’état solide cristallin.
Summary
| status | not read | reprioritisations | ||
|---|---|---|---|---|
| last reprioritisation on | suggested re-reading day | |||
| started reading on | finished reading on |