La caractéristique principale du diagramme d’état de l’eau ( pure ) est située sur la courbe de fusion (frontière entre les domaines d’existence du solide et du liquide). En effet, ici la courbe de fusion est décroissante, ce qui signifie que la pression de fusion de l’eau pure diminue au fur et à mesure que la température augmente (voir figure 1.8). Ce comportement, contraire à celui observé pour la plupart des corps purs, s'explique par le fait que la masse volumique de l’eau solide est inférieure à la masse volumique de l’eau liquide. De plus, les coordonnées du point triple et du point critique sont : T (273,2 K ; 0,008 bar) et C (647,2 K ; 221,0 bar). En outre, pour une pression supérieure à la pression atmosphérique, la température de solidification de l’eau est inférieure à 0 °C. Ainsi, en Arctique, il est possible d’observer de l’eau liquide sous les épaisses calottes de glace (parfois plusieurs kilomètres d’épaisseur) même à une température très inférieure à 0 °C ( car la pression y est > pression atmosphérique).
Le diagramme d’état (p, T) de l’eau permet de comprendre le procédé de lyophilisation, qui consiste à éliminer l’eau des aliments (en général d’origine végétale) en vue de leur conservation. En abaissant la température, les aliments gorgés d’eau sont solidifiés à pression constante (A → B). Une brusque détente produite à température constante (diminution de la pression B → C) et une augmentation de la température (C → D) provoquent la sublimation de l’eau. On obtient dès lors des aliments exempts d’eau à l’issue de ces transformations successives, résumées sur la figure 1.8 (évolution du système depuis le point A, jusqu’au point D). Notons qu’une transformation directe qui conduirait directement du point A au point D n’est pas satisfaisante pour les aliments dont on souhaite extraire l’eau (car la détente A → D provoque une explosion des cellules végétales).
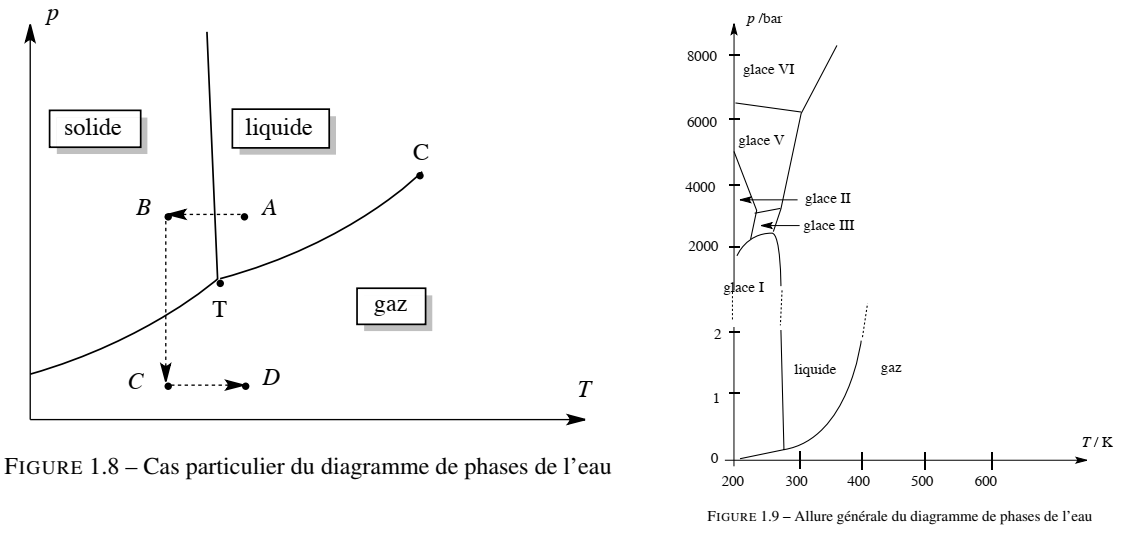
La figure 1.8 présente une version simplifiée du diagramme de phases de l’eau pure. Il faut savoir que la réalité des diagrammes de phases des corps purs est bien plus complexe, notamment à cause de l’existence de variétés allotropiques à l’état solide cristallin. Nous présentons à la figure 1.9 le diagramme de phases de l’eau pure en faisant apparaître différentes variétés allotropiques
de la glace (désignées sous la forme glace I, glace II, glace III, etc.). On notera le changement d’échelle sur l’axe des ordonnées à partir de la valeur de 2 bar.
Summary
| status | not read | reprioritisations | ||
|---|---|---|---|---|
| last reprioritisation on | suggested re-reading day | |||
| started reading on | finished reading on |