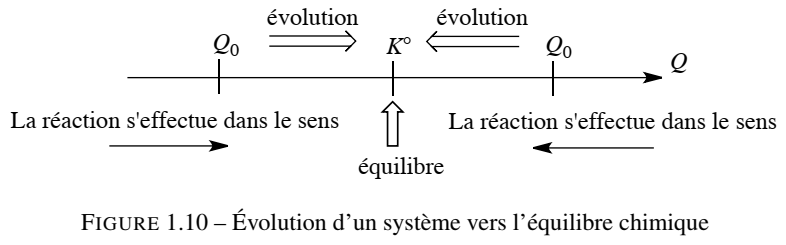
Pour un système thermodynamique qui subit une transformation chimique, la comparaison de la valeur numérique du quotient de réaction Q avec la constante d’équilibre éventuelle K°(T) permet de déduire le sens d’évolution du système. En effet :
- Si Q < K°(T), alors la réaction chimique a tendance à évoluer dans le sens de formation des produits (et de disparition des réactifs), afin de voir croître le quotient de réaction Q (et de se rapprocher de l’équilibre chimique). Et on dit alors que la réaction chimique s'éffectue dans le sens direct ( ou sens 1 ou sens → ).
- Si Q > K°(T), alors la réaction chimique a tendance à évoluer dans le sens de formation des réactifs (et de disparition des produits), afin de voir décroître le quotient de réaction Q (et de se rapprocher de l’équilibre chimique). Et on dit alors que la réaction chimique s'éffectue dans le sens indirect ( ou sens 2 ou sens -1 ou sens \(\leftarrow\) ).
- Et si Q = K°(T), alors le système thermodynamique est à l’équilibre chimique, et aucune évolution n’est observée.
On peut résumer graphiquement (sur la figure 1.10) l’évolution des systèmes thermodynamiques initiaux quelconques vers l’équilibre chimique en fonction de la valeur du quotient de réaction Q.
De plus, si une transformation chimique a déjà atteint l'équilibre chimique à la température T1 et si on modifie les valeurs des activités des constituants physico-chimiques (par exemple, par ajout de quantités de matières, ou la variation de pression pour une phase gazeuse), alors le quotient de réaction Q varie de nouveau et tend vers la nouvelle constante d'équilibre K2°(T2) . Et on dit alors que l'équilibre chimique se déplace .
Summary
| status | not read | reprioritisations | ||
|---|---|---|---|---|
| last reprioritisation on | suggested re-reading day | |||
| started reading on | finished reading on |