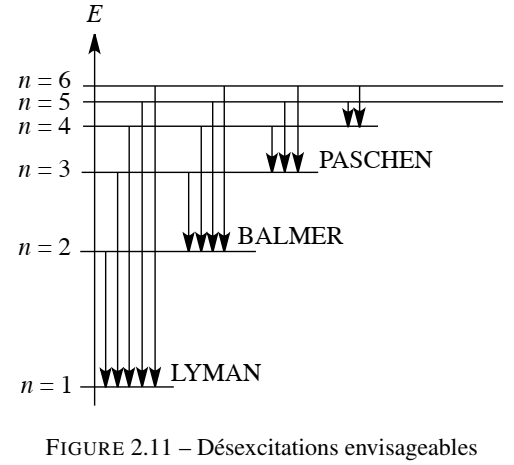
L’énergie de l’électron lié à l’atome (dans le cas précis de l’atome d’hydrogène) ne peut prendre que les valeurs : En = − 13.6 /(n2) (en eV) avec n qui est un nombre entier positif. Rappelons la valeur de l’électron-volt (eV) : 1 eV = 1,6 . 10−19 J. L’état d’énergie E = 0 (qui correspond à n → ∞) correspond à un électron libre de toute contrainte électrostatique (situé à l’infini du noyau de l’atome et sans énergie cinétique). Il s’agit donc de l’électron correspondant à un atome ionisé. L’état fondamental est l’état électronique d’énergie minimale correspondant à n = 1 (l’énergie d’un électron de l’atome d’hydrogène, dans son état fondamental, est −13,6 eV). Les états correspondant à un n supérieur sont qualifiés d’états excités (et correspondent à l’état d’un électron excité, ayant reçu un excédent d’énergie). Une série de raies d'émission est interprétée comme la manifestation de désexcitations, ayant toutes en commun le retour vers un niveau d’énergie En donné. Ainsi les désexcitations vers le niveau fondamental constituent la série de LYMAN, les transitions vers n = 2, 3 et 4 constituent respectivement les séries de BALMER, PASCHEN et BRACKETT. Chaque série est constituée d’un grand nombre de raies dont les longueurs d’onde se rapprochent et tendent vers une longueur d’onde limite (voir la figure 2.11).
Les résultats et raisonnements précédents sont généralisables aux ions hydrogénoïdes.
Summary
| status | not read | reprioritisations | ||
|---|---|---|---|---|
| last reprioritisation on | suggested re-reading day | |||
| started reading on | finished reading on |