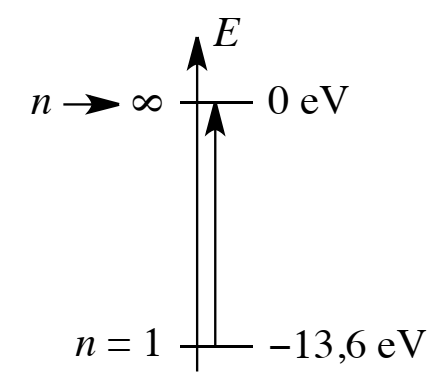
Processus d’ionisation : Calculer l’énergie minimale à fournir à un atome d’hydrogène (initialement dans son état fondamental) pour provoquer une ionisation (on parle alors d’énergie d’ionisation).
Réponse : L’énergie fournie sera absorbée si elle provoque une transition électronique (cas de l’électron lié). Pour procéder à une ionisation il faut au minimum provoquer une transition entre l’état fondamental (E = −13,6 eV, n = 1) et l’état ionisé (E = 0 eV, n →∞). La transition est schématisée à la figure ci-dessus. L’énergie à fournir (et susceptible d’être absorbée) est 13,6 eV, soit 21,8 . 10-19 J. Ceci peut être converti en J·mol-1 ou kJ·mol-1 : 21,8 . 10-19 J = 21,8 . 10-19 × NA = 1,3 . 106 J·mol-1 = 1.300 kJ·mol-1. NA = 6,02 . 1023 mol-1 est la constante d’AVOGADRO, et il correspond au nombre d’atomes d’hydrogène que l’on trouve dans une mole d’atomes d’hydrogène.
Summary
| status | not read | reprioritisations | ||
|---|---|---|---|---|
| last reprioritisation on | suggested re-reading day | |||
| started reading on | finished reading on |