Edited, memorised or added to reading queue
on 27-Apr-2017 (Thu)
Do you want BuboFlash to help you learning these things? Click here to log in or create user.
Flashcard 1450967436556
| status | not learned | measured difficulty | 37% [default] | last interval [days] | |||
|---|---|---|---|---|---|---|---|
| repetition number in this series | 0 | memorised on | scheduled repetition | ||||
| scheduled repetition interval | last repetition or drill |
Parent (intermediate) annotation
Open itPrimera fase: Marco de referencia. Es el momento actual que está viviendo la empresa sin llevar a cabo una reestructuración financiera. Es necesario conocer, entre otros, los niveles de ventas, costos, utilidades, f
Original toplevel document (pdf)
cannot see any pdfsFlashcard 1473834257676
| status | not learned | measured difficulty | 37% [default] | last interval [days] | |||
|---|---|---|---|---|---|---|---|
| repetition number in this series | 0 | memorised on | scheduled repetition | ||||
| scheduled repetition interval | last repetition or drill |
Parent (intermediate) annotation
Open itThe statement of changes in equity is organized to present for each component, the beginning balance, any increases during the period, any decreases during the period, and the ending balance.
Original toplevel document
3.1.3. Statement of Changes in Equityerves that represent accumulated other comprehensive income items are included in equity. The latter items may be shown separately or included in retained earnings. Volkswagen includes reserves as components of retained earnings. <span>The statement of changes in equity is organized to present, for each component of equity, the beginning balance, any increases during the period, any decreases during the period, and the ending balance. For paid-in capital, an example of an increase is a new issuance of equity and an example of a decrease is a repurchase of previously issued stock. For retained earnings, income (both n
Flashcard 1474064682252
| status | not learned | measured difficulty | 37% [default] | last interval [days] | |||
|---|---|---|---|---|---|---|---|
| repetition number in this series | 0 | memorised on | scheduled repetition | ||||
| scheduled repetition interval | last repetition or drill |
Parent (intermediate) annotation
Open itThis section is referred to by a variety of names, including management report(ing), management commentary, operating and financial review, and management’s discussion and analysis.
Original toplevel document
3.1.6. Management Commentary or Management’s Discussion and Analysisad> Publicly held companies typically include a section in their annual reports where management discusses a variety of issues of concern, including the nature of the business, past results, and future outlook. This section is referred to by a variety of names, including management report(ing), management commentary, operating and financial review, and management’s discussion and analysis. Inclusion of a management report is recommended by the International Organization of Securities Commissions and frequently required by regulatory authorities, such as the US Securities
Flashcard 1474338098444
| status | not learned | measured difficulty | 37% [default] | last interval [days] | |||
|---|---|---|---|---|---|---|---|
| repetition number in this series | 0 | memorised on | scheduled repetition | ||||
| scheduled repetition interval | last repetition or drill |
Parent (intermediate) annotation
Open itReading and evaluating financial statements for each company being analyzed includes reading the notes and understanding what accounting standards have been used, what accounting choices have been made and what operating decisions have been made that affect reported financial statements. <
Original toplevel document
4.3. Process Datag statistical analyses, such as regressions or Monte Carlo simulations; performing equity valuation; performing sensitivity analyses; or using any other analytical tools or combination of tools that are available and appropriate for the task. <span>A comprehensive financial analysis at this stage would include the following: Reading and evaluating financial statements for each company being analyzed. This includes reading the notes and understanding what accounting standards have been used (for example, IFRS or US GAAP), what accounting choices have been made (for example, when to report revenue on the income statement), and what operating decisions have been made that affect reported financial statements (for example, leasing versus purchasing equipment). Making any needed adjustments to the financial statements to facilitate comparison when the unadjusted statements of the subject companies reflect differences in accounting standards, accounting choices, or operating decisions. Note that commonly used databases do not make such analyst adjustments. Preparing or collecting common-size financial statement data (which scale data to directly reflect percentages [e.g., of sales] or changes [e.g., from the prior year]) and financial ratios (which are measures of various aspects of corporate performance based on financial statement elements). On the basis of common-size financial statements and financial ratios, analysts can evaluate a company’s relative profitability, liquidity, leverage, efficiency, and valuation in relation to past results and/or peers’ results. <span><body><html>
Flashcard 1474341506316
| status | not learned | measured difficulty | 37% [default] | last interval [days] | |||
|---|---|---|---|---|---|---|---|
| repetition number in this series | 0 | memorised on | scheduled repetition | ||||
| scheduled repetition interval | last repetition or drill |
Parent (intermediate) annotation
Open itReading the notes and understanding what accounting standards have been used (for example, IFRS or US GAAP)
Original toplevel document
4.3. Process Datag statistical analyses, such as regressions or Monte Carlo simulations; performing equity valuation; performing sensitivity analyses; or using any other analytical tools or combination of tools that are available and appropriate for the task. <span>A comprehensive financial analysis at this stage would include the following: Reading and evaluating financial statements for each company being analyzed. This includes reading the notes and understanding what accounting standards have been used (for example, IFRS or US GAAP), what accounting choices have been made (for example, when to report revenue on the income statement), and what operating decisions have been made that affect reported financial statements (for example, leasing versus purchasing equipment). Making any needed adjustments to the financial statements to facilitate comparison when the unadjusted statements of the subject companies reflect differences in accounting standards, accounting choices, or operating decisions. Note that commonly used databases do not make such analyst adjustments. Preparing or collecting common-size financial statement data (which scale data to directly reflect percentages [e.g., of sales] or changes [e.g., from the prior year]) and financial ratios (which are measures of various aspects of corporate performance based on financial statement elements). On the basis of common-size financial statements and financial ratios, analysts can evaluate a company’s relative profitability, liquidity, leverage, efficiency, and valuation in relation to past results and/or peers’ results. <span><body><html>
Flashcard 1478060281100
| status | not learned | measured difficulty | 37% [default] | last interval [days] | |||
|---|---|---|---|---|---|---|---|
| repetition number in this series | 0 | memorised on | scheduled repetition | ||||
| scheduled repetition interval | last repetition or drill |
Parent (intermediate) annotation
Open ittment portfolio at its current market value of $102,100. In contrast, the equipment in the IAL illustration was not reported at its current market value and no valuation adjustment was required. As this illustration demonstrates, <span>accounting regulations do not require all types of assets to be reported at their current market value. Some assets (e.g., trading securities) are shown on the balance sheet at their current market value, and changes in that market value are reported in the income statement. Some assets a
Original toplevel document
Open itved and the corresponding liability to deliver newsletters) and, subsequently, 12 future adjusting entries, the first one of which was illustrated as Transaction 12. Each adjusting entry reduces the liability and records revenue. <span>In practice, a large amount of unearned revenue may cause some concern about a company’s ability to deliver on this future commitment. Conversely, a positive aspect is that increases in unearned revenue are an indicator of future revenues. For example, a large liability on the balance sheet of an airline relates to cash received for future airline travel. Revenue will be recognized as the travel occurs, so an increase in this liability is an indicator of future increases in revenue. <span><body><html>
Flashcard 1479115934988
| status | not learned | measured difficulty | 37% [default] | last interval [days] | |||
|---|---|---|---|---|---|---|---|
| repetition number in this series | 0 | memorised on | scheduled repetition | ||||
| scheduled repetition interval | last repetition or drill |
Parent (intermediate) annotation
Open itSadness brings a drop in energy and enthusiasm for life's activities, particularly diversions and pleasures, and, as it deepens and approaches depression, slows the body's metabolism.</s
Original toplevel document (pdf)
cannot see any pdfs| status | not read | reprioritisations | ||
|---|---|---|---|---|
| last reprioritisation on | suggested re-reading day | |||
| started reading on | finished reading on |
Elektrophile Addition – Wikipedia
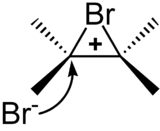
bonyle 6 Literatur 7 Weblinks Addition an die C=C-Doppelbindung[Bearbeiten | Quelltext bearbeiten] Addition von Halogenen an Alkene[Bearbeiten | Quelltext bearbeiten] [imagelink] [emptylink] Addition von Brom an ein Alken <span>Molekulare Halogene können in einem zweistufigen Mechanismus an die Doppelbindung von Alkenen addiert werden. Das Halogenmolekül tritt hierbei in Wechselwirkung mit der Doppelbindung des Alkens, wodurch das Halogenmolekül polarisiert wird und sich die Elektronenbindung heterolytisch spaltet. Im ersten Schritt erfolgt die Addition eines Haloniumions (hier als Beispiel: eines Bromoniumions (Br + )) an die Doppelbindung des Kohlenstoffatoms, bei der es unter Aufspaltung der Doppelbindung ein kurzlebiges cyclisches Kation bildet. Im zweiten Schritt greift das Halogenidion (hier: Bromidion) nukleophil am positivierten Kohlenstoffatom an, wodurch das gesättigte α,β-dihalogenierte Produkt erhalten wird. Die Addition von Halogenen ist auf die Elemente Chlor, Brom und Iod beschränkt. Molekulares Fluor hingegen ist hochreaktiv und würde unselektiv C-C- und C-H- Bindungen angreifen. Chlor ist elektronegativer und schlechter polarisierbar als Brom und Iod. Aus diesem Grund verläuft die Addition von Chlor über eine carbokationische Zwischenstufe, die nicht durch die Ausbildung einer cyclischen (nicht existenten) Chloroniumsstruktur stabilisiert ist. [imagelink] [emptylink] Anti-Addition von Brom an ein Alken Die Ausbildung von stabilisierten Kationen, wie sie für die Addition von Brom und Iod auftritt, bestimmt auch die Stereochemie des gebildeten Dihalogenids. Hierdurch wird eine Seite des Moleküls effektiv für nukleophile Angriffe abgeschirmt, sodass der Angriff nur noch von der gegenüberliegenden Seite stattfinden kann. Man spricht hierbei von einer anti-Addition. Dies führt dazu, dass bei der Addition von Brom und Iod mit hoher Selektivität das anti-Produkt gebildet wird. [imagelink] Addition von Halogenwasserstoffen[Bearbeiten | Quelltext bearbeiten] Auch Halogenwasserstoffsäuren können an Alkene addiert werden, wodurch Halogenalkane gebildet werden. Diese Addition verläuft ebenfalls zweistufig. Im ersten Schritt addiert das Proton der eingesetzten Säure an die Doppelbindung. Im Gegensatz zu Haloniumionen besitzt das Proton nicht die Fähigkeit die positive Ladung zu stabilisieren, weshalb ein Carbokation gebildet wird. An dieses addiert nun im zweiten Schritt das Anion der Säure. [imagelink] Bei dieser Addition können zwei verschiedene Produkte gebildet werden, die sich in der Position des Halogens unterscheiden. Welches der Produkte bevorzugt gebildet wird, hängt von der Stabilisierung des intermediären Carbokations ab und wird durch die Markownikow-Regel beschrieben, die besagt, dass das Wasserstoffatom immer an das bereits wasserstoffreichere Kohlenstoffatom gebunden wird. Bevorzugt wird das Produkt gebildet, das ein besser stabilisiertes Carbokation besitzt. In der Regel ist das stabilere Carbokation das höher alkylierte. Je nach Edukt können bei dieser Reaktion hohe Regioselektivitäten erzielt werden. Alkohole aus Alkenen[Bearbeiten | Quelltext bearbeiten] Addition von Wasser an Alkene[Bearbeiten | Quelltext bearbeiten] Wasser ist ein schlechtes Nukleophil, weshalb die Umsetzun